Ana Sayfa › Meteorolojik Bilgiler › e-kütüphane
Atmosferde stratosfer tabakası içerisinde bulunan ozon, ultraviyole radyasyonunun etkisiyle bir taraftan oluşurken, öbür taraftan da yok edilmektedir. Stratosfer tabakasındaki hava kütlesi, sürekli olarak güneşten gelen ultraviyole radyasyon tarafından şiddetli olarak etkilenmektedir. Bu aşamada, yer yüzeyindeki canlılar için büyük bir tehlike oluşturan Ultraviyole-B (UV-B) ışınlarının tamamına yakını stratosfer tabakasındaki ozon tarafından emilmektedir.
Bu işlem,
O3 + h υ ------> O2 + O reaksiyonu şeklinde oluşmaktadır. (λ = Dalga boyu < 243 nm) Bu reaksiyon sonucunda, ozon molekülü parçalanarak bir oksijen molekülü ve bir oksijen atomu açığa çıkmaktadır. Burada h, Plank sabiti; υ, UV-B ışınlarının frekansıdır.
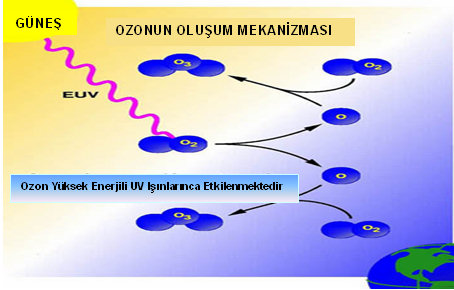
Ozon molekülünün oluşum mekanizması
(http://www.ccpo.odu.edu/~lizsmith/SEES/ozone/class/Chap_5/index.htm)
Yukarıdaki reaksiyon sonucu oluşan yeni serbest oksijen molekülü, ozon tabakası içerisindeki oksijen atomu ile reaksiyona girerek tekrar ozon molekülünü (O3) oluşturmaktadır.
O2 + O + M ---------> O3 + M
Burada M, reaksiyon esnasında açığa çıkan enerjiyi taşıyan üçüncü bir moleküldür
Bir ozon molekülü (O3), ultraviyole radyasyona maruz kaldığında O2 ve O olarak parçalanır. Parçalanma esnasında atomik ve moleküler oksijen kinetik enerji kazanarak ısıyı arttırır ve bu durum atmosfer sıcaklığının yükselmesine neden olur.
Ozon üretimi 240 nm’den daha kısa dalga boylu ultraviyole radyasyon tarafından sağlanır. Ozonun parçalanması ise 320 nm’den yüksek uzun dalga boylu ve 400 ile 700 nm aralığındaki kısa dalga boylu ultraviyole radyasyona maruz kaldığında meydana gelir. Ozon üretim ve parçalanma bölgesinin oluşturulmasında, daha uzun dalga boylu fotonlar atmosferin içine daha kolay işlemektedir. Bir ozon molekülü düşük enerjili ultraviyole radyasyonu emse bile, parçalanarak oksijen molekülüne ve serbest oksijen atomuna dönüşebilmektedir.
Ozonu yok eden başlıca kimyasal maddeler hidrojen, azot, klor ve brom içeren bileşiklerdir. X olarak HOx, ClOx, NOx veya BrOx, köklerinden biri alınırsa ozonu tahrip eden genel reaksiyon
X + O3 -------> XO + O2
XO + O -------> X + O2
-----------------------
O + O3 -------> O2 + O2
olarak gösterilebilir.
Burada bir tek katalizörün binlerce ozonu yok edebileceğine dikkat edilmelidir. Özellikle ClOx ve BrOx’in birlikte katalitik etkisi aşağı stratosferde ozonun tahrip edilmesinde temel rolü oynar.
BrO + ClO -------> Br + Cl + O2
Br + O3 -------> BrO + O2
Cl + O3 -------> ClO + O2
-----------------------
2O3 --------------> 3O2

Klor (Cl) atomunun ozon molekülünü parçalama ve yok etme mekanizması
(http://earthobservatory.nasa.gov/Library/Ozone/ozone_2.html).
Ozonu tahrip eden başlıca kimyasal bileşikler kloroflorokarbonlar (CFC2), karbon tetraklorür, metil kloroform, metan ve azot oksit gibi sanayide bolca kullanılan maddelerdir (Çizelge 2). Bunların kullanım yerleri, toplam içindeki payı ve atmosfer içindeki ömürleri aşağıdaki çizelgede verilmiştir.
| Çizelge: Ozonu yok eden başlıca kimyasal bileşikler. | ||||
|---|---|---|---|---|
| İsmi | Formülü | Kullanım Yeri | Yüzde (%) Payı | Ömrü (Yıl) |
| Halon-1301 | CBrF3 | Yangın Söndürücüler | 4 | 110 |
| Metil kloroform | CH3CCl33 | Solventler | 5 | 8 |
| Karbon tetraklorür | CCl4 | Solventler | 8 | 67 |
| CFC-113 | C2Cl3F3 | Solventler | 12 | 90 |
| CFC-11 | CCl3F | Aerosoller, Köpükler, Soğutucular | 26 | 74 |
| CFC-12 | CCl2F2 | Aerosoller, Köpükler, Soğutucular, Klimalar | 45 | 111 |
Ozon tabakasının incelmesi, daha fazla UV radyasyonunun yer yüzeyine ulaşması anlamına gelmektedir. Bu nedenle ozon UV-B radyasyonunun çoğunu emerek biyosferi korur ve yaşadığımız çevrede yaşamsal rol oynar. Bütün teorik ve deneysel çalışmalar göstermektedir ki, CFCs ve halonlar’ın atmosfere salınması, özellikle ilkbahar döneminde ozon tabakasının daha fazla yok olmasına ve Antarktik ozon deliğinin daha belirgin olarak ortaya çıkmasına neden olmaktadır.

Kloroflorokarbon (CFC) molekülü
(http://science.nasa.gov/media/medialibrary/2000/10/02/ast02oct_1_resources/CFCs.jpeg)
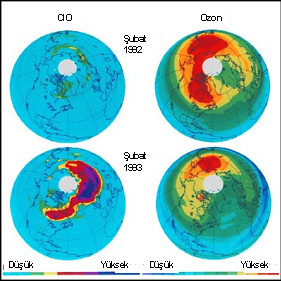
Kloroksit ve ozon arasındaki ilişki
(http://science.nasa.gov/media/medialibrary/2000/10/02/ast02oct_1_resources/CFCs.jpeg)
Ozonun Oluşumu ve Yokedilmesi [PDF] (596 Kb)